|
 Advanced GMP & Validation Solution Consulting Services Advanced GMP & Validation Solution Consulting Services
- We know what you need in the area of GMP & Validation.
- We offer a full range of GMP & Validation Solution Consulting Services.
바이오써포트는 2000년 이래로 의약품, 바이오의약품, 첨단바이오의약품, 동물용의약품, 의료기기, 건강기능식품 GMP Compliance를 위하여 소중한 고객님에게 밸리데이션을 기술 시험, 분석 서비스 및 검사를 기반으로 실행하고 있습니다. 또한, 바이오써포트는 다음의 분야별로 특성화하여 고객 중심으로 밸리데이션 시험 및 검사를 실행하고 있으며, 450건이 넘는 GMP컨설팅 및 밸리데이션 기술 시험, 분석 서비스의 경험을 바탕으로 신축 GMP제조소에 대한 종합컨설팅 프로젝트 수행에 핵심역량을 보유하고 있습니다.
- 개념설계 컨설팅(Conceptual Design Execution)
- 적격성평가 및 밸리데이션 계획, 수행, 보고(문서화) 및 솔루션 서비스Qualification & Validation Test, analysis & Documentation)
- 컴퓨터시스템 밸리데이션 계획, 수행, 보고(문서화) 및 솔루션 서비스(Computerized System Validation Test, analysis & Documentation)
- 제약바이오 엔지니어링 서비스(Pharmaceutical Engineering Service)
GMP Project Master Planning & Management Services
바이오써포트는 신축 GMP제조소 구축 프로젝트를 Management하기 위한 다음의 자원과 프로세스의 계획을 지원하여 고객사에서 프로젝트 위험을 최소화할 수 있도록 최선을 다합니다.
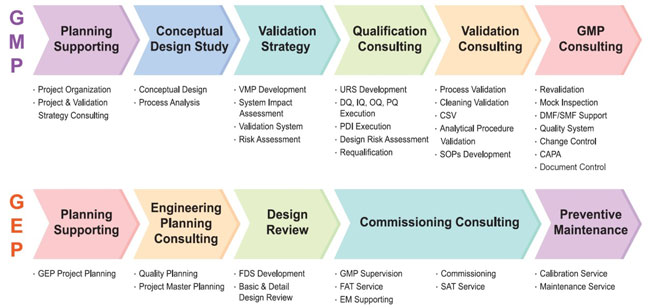
GMP Project Life Cycle and Our Services
GMP프로젝트의 라이프사이클은 다음과 같으며, 바이오써포트는 이 라이프사이클을 기반으로 최상의 서비스를 제공하고 있으며, 또한 지속적으로 개선을 하고 있습니다.
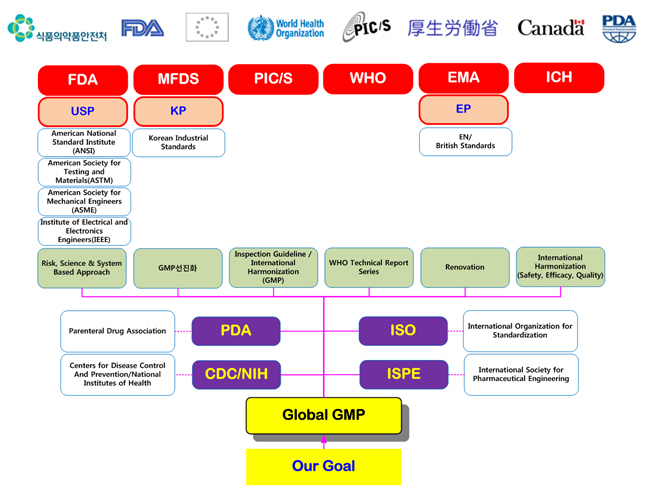
GMP Regulatory Agency for Global GMP Compliance
바이오써포트는 고객사가 목표로 하고 있는 글로벌 GMP에 부합되도록 하기 위하여 각국의 규제기관, 표준기관 등의 요구사항을 지속적으로 미래 예측적으로 분석하여 이를 GMP 및 밸리데이션 기술 시험, 분석 서비스에 반영하고 있습니다.
밸리데이션 관련 가이드라인
바이오써포트는 적격성평가 및 밸리데이션 기술 시험, 분석 서비스는 다음의 새로운 패러다임의 GMP 및 밸리데이션 가이드라인을 기반하여 실행합니다.
| KGMP |
의약품 등의 안전에 관한 규칙 별표 1 의약품 제조 및 품질관리기준, 총리령 |
|---|
| 의약품 제조 및 품질관리에 관한 규정 별표 13) 적격성평가와 밸리데이션, 식품의약품안전처 고시 |
| 생물의약품 제조공정 밸리데이션 가이드라인, 식품의약품안전처 |
| PIC/S GMP |
PIC/S GMP Guide Annex 15 Qualification and Validation, 2015 Revised |
|---|
| PIC/S GMP Guide Annex 1 Manufacture of Sterile Medicinal Products, 2022 Revised |
| PI 006-3 Recommendations on Validation Master Plan Installation and Operational Qualification Non-sterile Process Validation Cleaning Validation, PIC/S, 2007 |
| WHO GMP |
WHO TRS No 937 Annex 4: Supplementary Guidelines on Good Manufacturing Practices (GMP): Validation, WHO, 2006 |
|---|
WHO TRS No 992 Annex 3: Guidelines on good manufacturing practices: validation,
Appendix 7: non‑sterile process validation 2015 |
| CGMP |
Guidance for Industry Process Validation: General Principles and Practices (Revision 1), US FDA, 2011 |
|---|
| EU GMP |
Guideline on process validation for finished products - information and data to be provided in regulatory Submissions, EMA, 2014 |
|---|
| EUDRALEX Volume 4 Annex 15 Qualification and Validation, EMA, 2015 |
| EUDRALEX Volume 4 Annex 1 Manufacture of Sterile Medicinal Products, EMA, 2022 Revised |
|
|
 Validation Technology
Validation Technology
 밸리데이션 기술 소개
밸리데이션 기술 소개 Validation Technology
Validation Technology
 밸리데이션 기술 소개
밸리데이션 기술 소개